北京中卫永晟科技有限公司
热售电话:13910386853
热售电话:010-65731470

北京中卫永晟科技有限公司
热售电话:13910386853
热售电话:010-65731470
您所在的位置: 首页> 检测知识> 食品安全问题> 细菌总数、大肠菌群及致病菌的快速检测
水质安全风险监测与应急保障快速筛查
| 中卫牌水质微生物检测箱使用说明书 |
一、 适用范围
二、 实验前的准备工作及操作中的注意事项
三、 生活饮用水微生物常规指标及限值
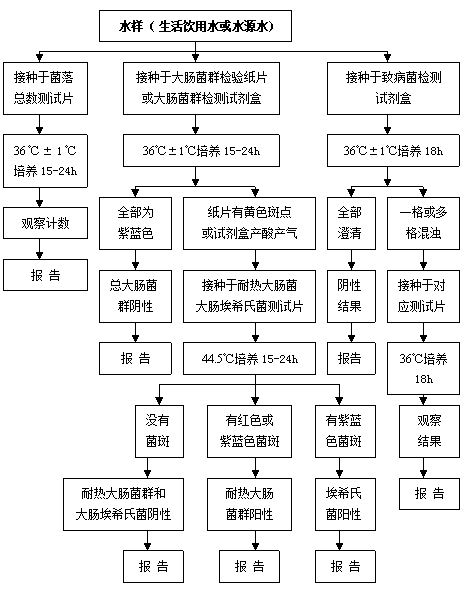
四、 检测流程图
五、 菌落总数测试片使用说明
六、 饮用水大肠菌群检验纸片使用说明
七、 水质大肠菌群检验纸片使用说明
八、 大肠菌群检测试剂盒使用说明
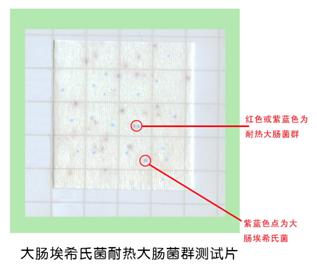
九、 大肠埃希氏菌耐热大肠菌群测试片使用说明
十、 致病菌检测试剂盒使用说明
十一、沙门氏菌测试片使用说明
十二、金黄色葡萄球菌测试片使用说明
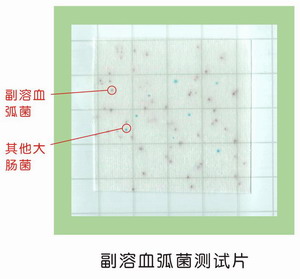
十三、副溶血弧菌测试片使用说明
十四、大肠杆菌O157测试片使用说明 围
十五、阪崎肠杆菌测试片使用说明
十六、蜡样芽胞杆菌测试片使用说明
一、适用范围
适用于生活饮用水及其水源水中卫生指标菌与致病菌的日常监测以及应急检测需要。
二、实验前的准备工作及操作中的注意事项
1 开展微生物快速检测所需的基本条件
1.1 一间通风良好、面积不需要很大的独立房间,房间里最好备有紫外线消
毒灯,洗手盆,实验台。应急检测时,临时性的房间应注意工作环境的的消毒
(如采用84消毒液消毒等),并备好酒精灯。
1.2 一台高压锅或红外线消毒柜(家用消毒碗柜也可。)应急检测时,应备
好消毒液,含氯消毒液的浓度在250ppm时,器皿消毒应保持5分钟以上。
1.3 一台小型恒温培养箱;
1.4 有条件时,配备一台普通冰箱,用于存放样品;
1.5 水质微生物采样检测箱,箱内备有采样用具与实验用的一些工具和器皿;
1.6 检测用试纸与试剂盒。
2 移液器的消毒
2.1 移液器管头的消毒:将管头放入锡箔袋或用锡箔纸包好,放入民用红外线
消毒柜中消毒;或将管头放入消毒液中浸泡,取用时注意甩干消毒液并用无菌
生理盐水冲洗三次。
3. 无菌操作和注意事项
3.1点燃酒精灯,营造局部无菌环境。取样和加样时尽量靠近酒精灯操作。能
用火焰消毒的操作工具如镊子、剪子、长柄勺、小刀等应在酒精灯上消毒后使用。
3.2 用75%酒精棉球将手抹擦消毒。
3.3 废弃物及时按照生物安全废弃物处理原则进行处理 。
三、生活饮用水微生物常规指标及限值
| 指 标 | 限 值 |
| 菌落总数(CFU/mL) | 100 |
| 总大肠菌群(MPN/100mL或CFU/100mL) | 不得检出 |
| 耐热大肠菌群(MPN/100mL或CFU/100mL) | 不得检出 |
| 大肠埃希氏菌(MPN/100mL或CFU/100mL) | 不得检出 |
MPN表示最可能数;CFU表示菌落形成单位。当水样检出总大肠菌群时,应进一 步检验大肠埃希氏菌或耐热大肠菌群;水样未检出总大肠菌群,不必检验大肠 埃希氏菌或耐热大肠菌群。
四、检测流程图
五、菌落总数测试片使用说明
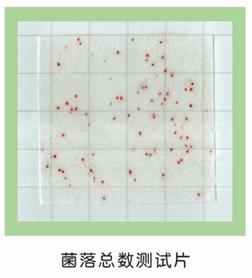
1 原理及适用范围:
菌落总数是指样品经过处理,在一定条件下培养后所得1mL(g)检样或单位
面积样品中所含菌落的总数,是最常用的检测项目指标。菌落总数测试片
(Aerobic Count Plates BB202)是一种预先制备好的一次性培养基产品,含
有标准的营养培养基,冷水可溶性的吸水凝胶和脱氢酶指示剂——氯化三苯基四
氮唑(TTC),菌落在测试片上呈紫红色或粉红色,这样可缩短计数时间和增
强计数效果。本产品适合于食品及水中菌落总数的测定,也可用于与食品接触
的容器操作台和其他设备表面的卫生检测。
6 计数原则及报告方式
6.1通常选择菌落在10~100个之间的测试片进行计数,乘以稀释倍数报告之(
见表1实例1)。
6.2若有两个稀释度的菌落数在10~100个之内,两者的比值小于2,则取其平
均数,若大于2,则用值小者(见表1实例2、例3)
6.3若三个稀释度的菌落数都有在10~100个之内,应选择二个低数值的平均数
(见表1实例4)。
6.4若三个稀释度的菌落数均小于10个或大于100个时,应重新试用更低或更高
的稀释度进行菌落计数;或采用均小于数量标准的最小值,或采用均大于数量
标准的最大值(见表1实例5、例6)。
6.5若所有稀释度的测试片均无生长,以未检出报告之。菌落数在100以内时按
实有数报告,大于100时,采样两位有效数字,在两位有效数字后面的数值,
以四舍五入方法计算,为了缩短数字后面的零数也可用10的指数来表示。
| 表1 稀释度选择及菌落总数报告方式 | ||||||
| 实例 | 稀释度 | 两稀释度之比 | 选定计数稀释度 | 报告方式(个/g或个/mL) | ||
| 10-1 | 10-2 | 10-3 | ||||
| 1 | 158 | 76 | 5 | — | 10-2 | 7.6×103 |
| 2 | 208 | 68 | 12 | 1.8 | 10-2、10-3 | 9.4×103 |
| 3 | 265 | 82 | 50 | 6.1 | 10-2 | 8.2×103 |
| 4 | 98 | 50 | 15 | — | 10-1、10-2 | 3.0×103 |
| 5 | 8 | 5 | 1 | — | 10-1 | 8.0×10 |
| 6 | 295 | 174 | 106 | — | 10-3 | 1.1×105 |
7 表面取样方法: 加1mL灭菌生理盐水在测试片上,静置至少1h使培养基凝固;提起上层膜,使中央滤纸部分贴到待测物表面,用手在外侧轻压;然后将上盖膜合上,置培养箱内培养。
六、饮用水大肠菌群检验纸片使用说明(五管法)
| 表2 用5份10mL水样时各种阳性和阴性结果组合时的最可能数(MPN) | |
| 阳性管或纸片数 | 总大肠菌群数(MPN/100mL) |
| 0 | 0或﹤2.2 |
| 1 | 2.2 |
| 2 | 5.1 |
| 3 | 9.2 |
| 4 | 16.0 |
| 5 | >16 |
七、水质大肠菌群检验纸片使用说明(十五管法)
八、总大肠菌群检测试剂盒使用说明
1.适用范围:
适用于二次供水、自来水、水源水、生活饮用水、矿泉水等样品中总大肠菌群
检测。对污染较严重的样品采用十五管法,其它可采用五管检测法。
2.方法原理:
与国标法相同。事先将乳糖蛋白胨培养基双料、乳糖蛋白胨培养基单料浓缩至
试剂盒培养孔中,随时取用。
3.操作方法:
3.1十五管法:
用无菌吸管吸取5个10mL水样分别加入到试剂盒1号~5号5个大发酵培养基孔内
。吸取5个1mL水样分别加入到试剂盒7号~11号5个小发酵培养基孔内。吸取5
个用灭菌生理盐水稀释后的1:10稀释液1mL加入到试剂盒12号~16号小发酵培
养基孔内。余孔可做对照。
3.2 五管法:
用无菌吸管吸取5个10mL水样分别加入到试剂盒1号~5号5个大发酵培养基管(
孔)内。余孔可做对照。
3.3 排气泡:
加样后集气窗内如有气泡存在,可将试剂盒以30~45度角倾斜使气泡排出,必
要时可轻轻用力在桌面上敲击数次排出气泡。
3.4 培养:
将加样后的试剂盒置36℃± 1℃温箱中,培养18h~24h。
3.5 观察结果:
样液变为黄色为产酸、集气窗中有气泡为产气,产酸产气者为阳性结果,可根
据试剂盒的阳性管数,参照国标GB/T5750.12-2006的方法,查表 MPN检索表(
表2或 表3),报告每100mL水样中的总大肠菌群最可能数。如需对阳性结果进
一步证实,可参考GB/T5750.12-2006方法进行。如所有管数均为阴性时,可报
告总大肠菌群未检出。
4. 注意事项:
4.1加入样品后不需摇匀,平拿平放。
4.2 加样时可用一次性无菌塑料吸管,将样品稀释液加至试剂盒所标刻度处。
4.3 在培养箱中取试剂盒时应平托出来,不要倾斜以免由于试剂盒的倾斜将阳
性管集气窗中的气泡排出而影响结果。
4.4 试剂盒为一次性无菌用品,供一次性使用。
 |
|
表3 十五管法总大肠菌群(MPN)检索表 (总接种量55.5 mL,其中5份10 mL水样,5份1mL水样,5份0.1 mL水样) |
|||||||
| 接种量,mL | 总大肠菌群 (MPN/100mL) |
接种量,mL | 总大肠菌群 (MPN/100mL) |
||||
| 10 | 1 | 0.1 | 10 | 1 | 0.1 | ||
| 0 | 0 | 0 | <2 | 1 | 0 | 0 | 2 |
| 0 | 0 | 1 | 2 | 1 | 0 | 1 | 4 |
| 0 | 0 | 2 | 4 | 1 | 0 | 2 | 6 |
| 0 | 0 | 3 | 5 | 1 | 0 | 3 | 8 |
| 0 | 0 | 4 | 7 | 1 | 0 | 4 | 10 |
| 0 | 0 | 5 | 9 | 1 | 0 | 5 | 12 |
| 0 | 1 | 0 | 2 | 1 | 1 | 0 | 4 |
| 0 | 1 | 1 | 4 | 1 | 1 | 1 | 6 |
| 0 | 1 | 2 | 6 | 1 | 1 | 2 | 8 |
| 0 | 1 | 3 | 7 | 1 | 1 | 3 | 10 |
| 0 | 1 | 4 | 9 | 1 | 1 | 4 | 12 |
| 0 | 1 | 5 | 11 | 1 | 1 | 5 | 14 |
| 0 | 2 | 0 | 4 | 1 | 2 | 0 | 6 |
| 0 | 2 | 1 | 6 | 1 | 2 | 1 | 8 |
| 0 | 2 | 2 | 7 | 1 | 2 | 2 | 10 |
| 0 | 2 | 3 | 9 | 1 | 2 | 3 | 12 |
| 0 | 2 | 4 | 11 | 1 | 2 | 4 | 15 |
| 0 | 2 | 5 | 13 | 1 | 2 | 5 | 17 |
| 0 | 3 | 0 | 6 | 1 | 3 | 0 | 8 |
| 0 | 3 | 1 | 7 | 1 | 3 | 1 | 10 |
| 0 | 3 | 2 | 9 | 1 | 3 | 2 | 12 |
| 0 | 3 | 3 | 11 | 1 | 3 | 3 | 15 |
| 0 | 3 | 4 | 13 | 1 | 3 | 4 | 17 |
| 0 | 3 | 5 | 15 | 1 | 3 | 5 | 19 |
| 0 | 4 | 0 | 8 | 1 | 4 | 0 | 11 |
| 0 | 4 | 1 | 9 | 1 | 4 | 1 | 13 |
| 0 | 4 | 2 | 11 | 1 | 4 | 2 | 15 |
| 0 | 4 | 3 | 13 | 1 | 4 | 3 | 17 |
| 0 | 4 | 4 | 15 | 1 | 4 | 4 | 19 |
| 0 | 4 | 5 | 17 | 1 | 4 | 5 | 22 |
| 0 | 5 | 0 | 9 | 1 | 5 | 0 | 13 |
| 0 | 5 | 1 | 11 | 1 | 5 | 1 | 15 |
| 0 | 5 | 2 | 13 | 1 | 5 | 2 | 17 |
| 0 | 5 | 3 | 15 | 1 | 5 | 3 | 19 |
| 0 | 5 | 4 | 17 | 1 | 5 | 4 | 22 |
| 0 | 5 | 5 | 19 | 1 | 5 | 5 | 24 |
| 续表 | |||||||
| 接种量,mL | 总大肠菌群 (MPN/100mL) |
接种量,mL | 总大肠菌群 (MPN/100mL) |
||||
| 10 | 1 | 0.1 | 10 | 1 | 0.1 | ||
| 2 | 0 | 0 | 5 | 3 | 0 | 0 | 8 |
| 2 | 0 | 1 | 7 | 3 | 0 | 1 | 11 |
| 2 | 0 | 2 | 9 | 3 | 0 | 2 | 13 |
| 2 | 0 | 3 | 12 | 3 | 0 | 3 | 16 |
| 2 | 0 | 4 | 14 | 3 | 0 | 4 | 20 |
| 2 | 0 | 5 | 16 | 3 | 0 | 5 | 23 |
| 2 | 1 | 0 | 7 | 3 | 1 | 0 | 11 |
| 2 | 1 | 1 | 9 | 3 | 1 | 1 | 14 |
| 2 | 1 | 2 | 12 | 3 | 1 | 2 | 17 |
| 2 | 1 | 3 | 14 | 3 | 1 | 3 | 20 |
| 2 | 1 | 4 | 17 | 3 | 1 | 4 | 23 |
| 2 | 1 | 5 | 19 | 3 | 1 | 5 | 27 |
| 2 | 2 | 0 | 9 | 3 | 2 | 0 | 14 |
| 2 | 2 | 1 | 12 | 3 | 2 | 1 | 17 |
| 2 | 2 | 2 | 14 | 3 | 2 | 2 | 20 |
| 2 | 2 | 3 | 17 | 3 | 2 | 3 | 24 |
| 2 | 2 | 4 | 19 | 3 | 2 | 4 | 27 |
| 2 | 2 | 5 | 22 | 3 | 2 | 5 | 31 |
| 2 | 3 | 0 | 12 | 3 | 3 | 0 | 17 |
| 2 | 3 | 1 | 14 | 3 | 3 | 1 | 21 |
| 2 | 3 | 2 | 17 | 3 | 3 | 2 | 24 |
| 2 | 3 | 3 | 20 | 3 | 3 | 3 | 28 |
| 2 | 3 | 4 | 22 | 3 | 3 | 4 | 32 |
| 2 | 3 | 5 | 25 | 3 | 3 | 5 | 36 |
| 2 | 4 | 0 | 15 | 3 | 4 | 0 | 21 |
| 2 | 4 | 1 | 17 | 3 | 4 | 1 | 24 |
| 2 | 4 | 2 | 20 | 3 | 4 | 2 | 28 |
| 2 | 4 | 3 | 23 | 3 | 4 | 3 | 32 |
| 2 | 4 | 4 | 25 | 3 | 4 | 4 | 36 |
| 2 | 4 | 5 | 28 | 3 | 4 | 5 | 40 |
| 2 | 5 | 0 | 17 | 3 | 5 | 0 | 25 |
| 2 | 5 | 1 | 20 | 3 | 5 | 1 | 29 |
| 2 | 5 | 2 | 23 | 3 | 5 | 2 | 32 |
| 2 | 5 | 3 | 26 | 3 | 5 | 3 | 37 |
| 2 | 5 | 4 | 29 | 3 | 5 | 4 | 41 |
| 2 | 5 | 5 | 32 | 3 | 5 | 5 | 45 |
| 续表 | |||||||
| 接种量,mL | 总大肠菌群 (MPN/100mL) |
接种量,mL | 总大肠菌群 (MPN/100mL) |
||||
| 10 | 1 | 0.1 | 10 | 1 | 0.1 | ||
| 4 | 0 | 0 | 13 | 5 | 0 | 0 | 23 |
| 4 | 0 | 1 | 17 | 5 | 0 | 1 | 31 |
| 4 | 0 | 2 | 21 | 5 | 0 | 2 | 43 |
| 4 | 0 | 3 | 25 | 5 | 0 | 3 | 58 |
| 4 | 0 | 4 | 30 | 5 | 0 | 4 | 76 |
| 4 | 0 | 5 | 36 | 5 | 0 | 5 | 95 |
| 4 | 1 | 0 | 17 | 5 | 1 | 0 | 33 |
| 4 | 1 | 1 | 21 | 5 | 1 | 1 | 46 |
| 4 | 1 | 2 | 26 | 5 | 1 | 2 | 63 |
| 4 | 1 | 3 | 31 | 5 | 1 | 3 | 84 |
| 4 | 1 | 4 | 36 | 5 | 1 | 4 | 110 |
| 4 | 1 | 5 | 42 | 5 | 1 | 5 | 130 |
| 4 | 2 | 0 | 22 | 5 | 2 | 0 | 49 |
| 4 | 2 | 1 | 26 | 5 | 2 | 1 | 70 |
| 4 | 2 | 2 | 32 | 5 | 2 | 2 | 94 |
| 4 | 2 | 3 | 38 | 5 | 2 | 3 | 120 |
| 4 | 2 | 4 | 44 | 5 | 2 | 4 | 150 |
| 4 | 2 | 5 | 50 | 5 | 2 | 5 | 180 |
| 4 | 3 | 0 | 27 | 5 | 3 | 0 | 79 |
| 4 | 3 | 1 | 33 | 5 | 3 | 1 | 110 |
| 4 | 3 | 2 | 39 | 5 | 3 | 2 | 140 |
| 4 | 3 | 3 | 45 | 5 | 3 | 3 | 180 |
| 4 | 3 | 4 | 52 | 5 | 3 | 4 | 210 |
| 4 | 3 | 5 | 59 | 5 | 3 | 5 | 250 |
| 4 | 4 | 0 | 34 | 5 | 4 | 0 | 130 |
| 4 | 4 | 1 | 40 | 5 | 4 | 1 | 170 |
| 4 | 4 | 2 | 47 | 5 | 4 | 2 | 220 |
| 4 | 4 | 3 | 54 | 5 | 4 | 3 | 280 |
| 4 | 4 | 4 | 62 | 5 | 4 | 4 | 350 |
| 4 | 4 | 5 | 69 | 5 | 4 | 5 | 430 |
| 4 | 5 | 0 | 41 | 5 | 5 | 0 | 240 |
| 4 | 5 | 1 | 48 | 5 | 5 | 1 | 350 |
| 4 | 5 | 2 | 56 | 5 | 5 | 2 | 540 |
| 4 | 5 | 3 | 64 | 5 | 5 | 3 | 920 |
| 4 | 5 | 4 | 72 | 5 | 5 | 4 | 1600 |
| 4 | 5 | 5 | 81 | 5 | 5 | 5 | >1600 |

十一、沙门氏菌测试片使用说明
1适用范围及原理:
适用于生活饮用水、水源水及食品等中沙门氏菌的检测以及突发事件
应急需要。沙门氏菌属肠道细菌科,包括那些引起食物中毒、导致肠胃
炎、伤寒和副伤寒的细菌。能引起食物传播性疾病,近年来,已经成为
最常见的食物中毒原因。肠炎沙门氏菌感染通常源于奶制品、禽产品和
肉产品;鸡肉和鸡蛋尤其是高风险食品。沙门氏菌感染的症状通常是肠
胃出现问题,包括恶心、腹部绞痛、呕吐和腹泻,一般最多持续7天。
在免疫力低下的人群中,如果不及时服用抗生素类药品,沙门氏菌感染
将导致生命危险。沙门氏菌测试片(Salmonella Count Plate BS205)
含有选择性培养基、沙门氏菌特有辛酯酶的显色指示剂和高分子吸水凝胶,
运用微生物测试片专有技术,做成一次性快速检验产品,一步培养
15-24h就可确认是否带有沙门氏菌。
2 操作方法
2.1 样品处理:
生活饮用水及其水源水取原液。其他样品取 25g(mL)放入含有
225 mL灭菌生理盐水的取样罐或均质杯内,制成1:10的样品匀液。
2.2 接种:
将沙门氏菌测试片(BS205)置于平坦实验台面,揭开上层膜,
用无菌吸管吸取1mL样品匀液慢慢均匀地滴加到纸片上,然后再
将上层膜缓慢盖下,静置5 min使培养基凝固,最后用手轻轻地
压一下,每个样品接种两片。
2.3 培养:
将测试片叠在一起放回原自封袋中,透明面朝上水平置于恒温培养
箱内,堆叠片数不超过12片。培养温度为36℃±1℃,培养15~24h。
3 结果判读:
对测试片进行观察,呈紫红色的菌落为沙门氏菌;呈蓝色的菌落为其
他菌群。出现阳性菌落的样本,最好用其他更为可靠的方法进行验证,
没有条件的话至少再取样重复检验一次。
4 附加说明
4.1有关验证试验表明,接纯菌种(包括硫化氢阴性菌株)可以产生
典型的紫红色菌斑,其他肠杆菌呈蓝色,葡萄球菌不生长。
4.2测试片具有较强的敏感性,在1.5×10-8稀释时仍可计算出菌落。
临床实际应用结果显示阳性检出率高于分离培养法1.84‰,复查准确
率提高约13.0%(中国卫生检验杂志2006,16(8):954-955.)。
4.3注意使用过的测试片上带有活菌,需及时按
照生物安全废弃物处理原则进行处理 。
十二、金黄色葡萄球菌测试片使用说明
1适用范围及原理:
适用于生活饮用水、水源水及食品等中金黄色葡萄球菌的检测以及
突发事件应急需要。金黄色葡萄球菌(Staphylococcus aureus简称金葡菌)
是人类最常见的致病菌之一,其侵袭力很强,能产生多种致病物质如:
肠毒素、凝固酶等;可引起化脓性炎症、毒素性疾病及葡萄球菌性肠炎。
金葡菌所引起的中毒事件已成为世界性的公共卫生问题,我国每年由金
葡菌引起的食物中毒事件屡有报道。金黄色葡萄球菌测试片
(Staph Count Plate BT206)含有选择性培养基和专一性的酶显色剂,
运用微生物测试片专有技术,做成一次性快速检验产品,
一步培养15-24h就可确定出病原菌的存在。
2 操作方法
2.1 样品处理:
生活饮用水及其水源水取原液。其他样品取 25g(mL)放入含有
225 mL灭菌生理盐水的取样罐或均质杯内,制成1:10的样品匀液。
2.2 接种:
将金黄色葡萄球菌测试片(BT206)置于平坦实验台面,揭开上层膜,
用无菌吸管吸取1mL样品匀液慢慢均匀地滴加到纸片上,然后再将上
层膜缓慢盖下,静置5 min使培养基凝固,最后用手轻轻地压一下,
每个样品接种两片。
2.3 培养:
将测试片叠在一起放回原自封袋中,透明面朝上水平置于恒温培养箱内,
堆叠片数不超过12片。培养温度为36℃±1℃,培养15~24h。
3 结果判读:
紫红色的菌落为金黄色葡萄球菌;呈蓝色的菌落为其他大肠菌群。
出现阳性菌落的样本,最好用其他更为可靠的方法进行验证,
没有条件的话至少再取样重复检验一次。
4 附加说明
4.1有关验证试验表明,金黄色葡萄球菌测试片接纯菌种可以产生
典型的紫红色菌斑,普通大肠杆菌呈蓝色菌落,而沙门氏菌,
变形杆菌在测试片上不生长。测试片的敏感度为1.2×10-8。
通过检测211份糕点、熟肉、鲜肉和奶制品样品,测试片法和
国标法的阳性率分别为10.43%和7.58%(中国卫生检验杂
志2007,17(8):1456-1457.)。
4.2山东省疾病预防控制中心的验证结果表明,当金黄色葡萄球菌
在0~9个菌落范围内时,测试片与血平板均能检出,作为致病菌
不得捡出的标准要求,可以作为金黄色葡萄球菌检验应用。
4.3注意使用过的测试片上带有活菌,需及时按
照生物安全废弃物处理原则进行处理 。